نقش کلسترول و ژن APOE4 در بروز آلزایمر | بررسی علمی انتقال کلسترول در مغز
1. مقدمه
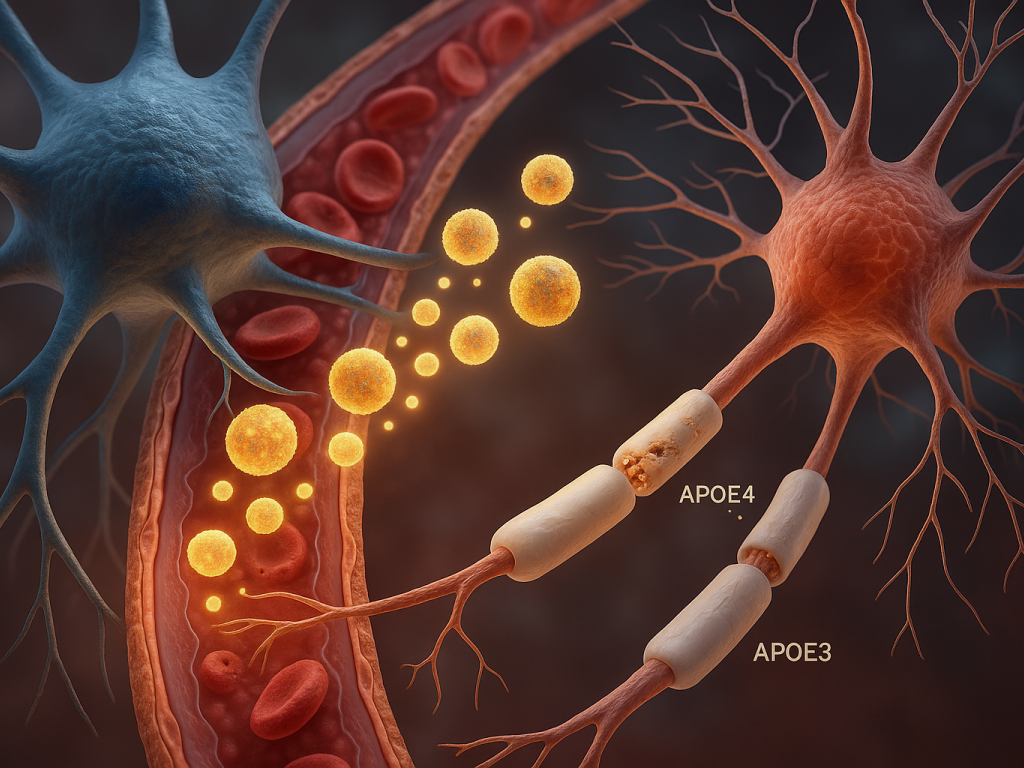
بیماری آلزایمر به عنوان یکی از رایجترین علل زوال عقل در سطح جهان، سالهاست که مورد توجه پژوهشگران و متخصصان علوم اعصاب قرار گرفته است. از آنجا که ترسیم نقشه دقیق مکانیسمهای مولکولی منجر به بروز این بیماری، میتواند در شناسایی مسیرهای درمانی نوین مؤثر باشد، موضوع انتقال کلسترول در مغز به ویژه در زمینه تأثیر ژن APOE4، اهمیت ویژهای پیدا کرده است. کلسترول مولکولی ضروری برای عملکرد صحیح سلولهای عصبی بهشمار میآید؛ از ساختار پلاسمایی غشاهای سلولی گرفته تا تأمین منابع مورد نیاز برای انتقال سیگنالهای الکتریکی و تولید میلین، این مولکول نقش مهمی در بقا و کارکرد نورونها ایفا میکند ، . به دلیل وجود سد خونی مغز، عمده کلسترول مورد نیاز توسط سلولهای مغزی بهصورت داخلی سنتز میشود و از خون قابل دسترسی نمیباشد ؛ بنابراین، حفظ تعادل دقیق بین سنتز، انتقال، استفاده و دفع کلسترول در مغز امری حیاتی محسوب میشود.
ژنتیک نیز عامل معناداری در ایجاد آلزایمر بهشمار میآید و از میان شاخصههای ژنتیکی، ژن APOE بدون شک پرآوازهترین و قویترین عامل خطر برای این بیماری است ، . ایزوفرمهای مختلف این ژن نه تنها در متابولیسم لیپیدها بلکه در تعاملات میان نورونها و سلولهای پشتیبان مغز (گلیا) نقش کلیدی دارند. تحقیقات اخیر نشان دادهاند که اختلال در انتقال کلسترول از سلولهای گلیال به نورونها، به ویژه در حضور نوبهای از ژن APOE4، میتواند موجب نقص در عملکرد نورونی و در نهایت افزایش آسیبهای مرتبط با آلزایمر شود ، .
در این مقاله علمی، به تحلیل عمیق مطالعات مختلف در زمینه نقش انتقال کلسترول و تأثیر ژن APOE4 در بروز بیماری آلزایمر پرداخته میشود. هدف اصلی این پژوهش، بررسی روند انتقال کلسترول از سلولهای آستروسیت (یکی از مهمترین سلولهای گلیا) به نورونها، مشکلات ناشی از نقص این فرآیند و ارتباط مستقیم آن با افزایش خطر اپتوپاتی عصبی و تشکیل پلاکهای آمیلوئیدی در مغز است ، . در ادامه به تفصیل به مرور ادبیات، تشریح روشهای بهکار رفته در مطالعات، نتایج تجربی و بحث پیرامون آنها پرداخته خواهد شد.
2. مرور ادبیات
2.1. متابولیسم کلسترول در مغز
کلسترول یکی از چربیهای ضروری در بدن است که در مغز به وفور وجود دارد و نقشهای متعددی از جمله تأمین ساختار غشایی سلولهای عصبی، انعطافپذیری و سلامت سیناپسها، و سازگاری در فرآیندهای مولکولی را ایفا میکند ، . برخلاف سایر اندامهای بدن که از کلسترول وارد شده از جریان خون بهره میبرند، مغز به دلیل وجود سد خونی مغز (BBB) بیشتر به تولید درون سلولی متکی است ، . سلولهای عصبی عمدتاً از کلسترول سنتز شده در سلولهای آستروسیت بهره میبرند تا با انتقال به نورونها، تغذیه لازم را دارند ، .
از سویی دیگر، کلسترول در فرآیند تشکیل میلین که پوششی محافظ اطراف الیگودندروسیتها به شمار میآید نیز نقش دارد. میلیناسیون، فرآیندی که برای انتقال سریع سیگنالهای الکتریکی بین نورونها حیاتی است، به شدت به وجود کلسترول در غشاهای سلولی وابسته است ، . علاوه بر این، کلسترول در تبدیل به اکسیکلسترولها مانند 24-هیدروکسیکلسترول نیز مشارکت دارد که از طریق آنها فرآیند دفع کلسترول از مغز تنظیم میشود ، . بنابراین، هر گونه ناهنجاری در سنتز، انتقال یا دفع این مولکول میتواند اثرات قابل توجهی بر عملکرد نورونی و سلامت کلی مغز داشته باشد.
2.2. نقش سلولهای گلیال و نورونی در انتقال کلسترول
سلولهای گلیال، به ویژه آستروسیتها، به عنوان تولیدکننده اصلی کلسترول در مغز عمل میکنند. آستروسیتها پس از سنتز کلسترول، آن را در قالب ذرات لیپوپروتئینی حاوی پروتئین APOE ذخیره و به نورونها تحویل میدهند ، . این فرآیند انتقال از طریق گیرندههای سطح سلولی مانند LDLR و LRP1 صورت میگیرد که نورونها برای جذب کلسترول به آنها متکی هستند ، .
مطالعات متعدد نشان دادهاند که انتقال بهینهٔ کلسترول از آستروسیتها به نورونها برای رشد و تثبیت سیناپسها حیاتی است. در واقع، تکامل سیناپتیک و پایداری ارتباطات سلولی در دورههای مختلف رشد و بلوغ مغز به شدت متکی به تعادل مناسب سطح کلسترول در مغز میباشد ، . علاوه بر این، نقص در این انتقال میتواند به اختلالات نورونی و ایجاد بروز علائم اولیه آلزایمر منجر شود.
جدولی در ادامه تفاوتهای عملکردی بین سلولهای گلیال و نورونی در انتقال کلسترول ارائه میدهد:
| نوع سلول | عملکرد اصلی در انتقال کلسترول | گیرندههای اصلی | نتیجه نهایی در عملکرد نورونی |
|---|---|---|---|
| آستروسیت | سنتز و ترشح کلسترول در قالب لیپوپروتئین | N/A | تهیه منبع اصلی کلسترول برای نورونها |
| نورون | جذب کلسترول از لیپوپروتئینهای آستروسیت | LDLR، LRP1 | حفظ پایداری سیناپسی و ساختار غشایی |
2.3. تأثیر ژن APOE4 بر انتقال کلسترول
ژنتیک در ایجاد آلزایمر نقش گستردهای دارد و از میان ژنهای مرتبط، APOE نقش پررنگی بر متابولیسم لیپیدها دارد. سه ایزوفرم اصلی APOE عبارتند از APOE2، APOE3 و APOE4 که در میان جمعیت انسان به ترتیب با فرکانسهای مختلف دیده میشوند ، . در حالی که APOE3 به عنوان ایزوفرم مرجع و بیتأثیر شناخته میشود، ژنهای APOE2 و به ویژه APOE4 تأثیرات متفاوتی دارند. APOE2 با کاهش خطر آلزایمر همراه است، در حالی که APOE4 به عنوان بزرگترین عامل ژنتیکی خطر برای آلزایمر شناخته شده و با افزایش خطر بیماری به صورت دوزواِ ، .
تحقیقات نشان دادهاند که در حضور ایزوفرم APOE4، لیپوپروتئینهای ترشح شده توسط آستروسیتها نسبت به انتقال بهتر کلسترول به نورونها ناتوان هستند. به بیان دیگر، حتی در شرایطی که مقدار کل کلسترول تولید شده در مغز تغییر چندانی نمیکند، کارایی انتقال و انتقال به نورونها دچار اختلال میشود ، . این اختلال در فرآیند انتقال کلسترول موجب بروز مشکلات متعددی مانند نقص در تثبیت سیناپسها، کاهش میلیناسیون و نهایتاً افزایش آسیب نورونی به علت تجمع ناقص کلسترول در سلولهای مختلف میگردد ، .
در مطالعات انجام شده بر روی مدلهای سلولی و حیوانی، مشاهده شده است که لیپوپروتئینهای حاصل از ترکیبهای نوترکیب که تنها تفاوتشان دارا بودن APOE4 یا APOE3 بوده، نشاندهندهٔ انتقال متفاوت کلسترول به نورونها بودهاند؛ به طوری که نمونههای حاوی APOE4 به طور قابل توجهی کارایی کمتری در تحویل کلسترول به نورونها داشتهاند ، . این یافتهها به وضوح نشان میدهند که نقص عملکردی در فرآیند انتقال کلسترول ناشی از APOE4، یک مکانیسم مهم در زمینه بروز و پیشرفت بیماری آلزایمر محسوب میشود.
برای درک بهتر تأثیرات ژنتیکی و تفاوتهای ایزوفرمی، جدولی مقایسهای از خصوصیات ایزوفرمهای مختلف APOE ارائه میشود:
| ویژگی | APOE2 | APOE3 | APOE4 |
|---|---|---|---|
| فرکانس در جمعیت | کمتر؛ با اثر محافظتی | رایجترین ایزوفرم | حدود 14٪ در جمعیت قارهای؛ عامل خطر بالا |
| کارایی لیپیداسیون | لیپیداسیون مطلوب | عملکرد نرمال | لیپیداسیون پایین؛ انتقال ناقص کلسترول |
| ریسک آلزایمر | کاهش ریسک | ریسک مرجع | افزایش ریسک تا 15 برابر در هموزیگوتها |

3. روششناسی پژوهشهای مورد بررسی
برای بررسی دقیق نقش انتقال کلسترول در مغز و تأثیر ژن APOE4 بر این فرآیند، پژوهشگران از روشها و ابزارهای متنوعی استفاده کردهاند. در این بخش نکات کلیدی روششناسی مطالعات بررسی شده آمده است:
3.1. نمونهگیری و تحلیل مایع مغزی نخاعی
در برخی از پژوهشهای مهم، نمونههای مایع مغزی نخاعی بیماران آلزایمر و افراد کنترل غربالگری شده و مقایسههایی در سطح لیپوپروتئینهای حامل کلسترول انجام شده است. این مطالعات نشان دادهاند که اگرچه ترشح کل کلسترول توسط آستروسیتها در همه نمونهها تقریباً مشابه است، اما جذب کلسترول توسط نورونها بهویژه در بیماران آلزایمر دچار نقص جدی میشود ، . از دادههای این مطالعات، مشخص شده است که در حضور ژن APOE4، جذب نورونی از کلسترول به طور قابل توجهی کاهش یافته است ، .
3.2. استفاده از مدلهای سلولی و حیوانی
مدلهای سلولی (مانند سلولهای مشتق شده از iPSC) و مدلهای حیوانی (مانند مدلهای موش مبتلا به آلزایمر) به طور گسترده در این تحقیقات به کار گرفته شدهاند. پژوهشگران با استفاده از سلولهای آستروسیت حاوی APOE3 یا APOE4 و همراه کردن آنها با نورونهای مربوطه، تفاوت در بهرهوری انتقال کلسترول را مورد بررسی قرار دادهاند. نتایج این مطالعات نشان میدهد که لیپوپروتئینهای حاصل از آستروسیتهای حامل APOE4، در مقایسه با نمونههای حامل APOE3، قادر به تحویل کلسترول به نورونها به طور مؤثر نیستند ، .
3.3. تجزیه و تحلیل پروتئومیک
یکی از رویکردهای نوین در این حوزه، استفاده از تجزیه و تحلیل پروتئومیک است که طی آن ساختار پروتئینهای موجود در لیپوپروتئین مایع مغزی نخاعی مورد بررسی قرار میگیرد. به عنوان مثال، در یک مطالعه، 239 پروتئین شناسایی شده و از این تعداد، 27 پروتئین در بیماران آلزایمر تغییرات معناداری نشان دادند. اگرچه برخی از این تغییرات مستقیماً به متابولیسم کلسترول مرتبط نبودند، اما نشانگر پیچیدگی زیاد سیستم لیپوپروتئینی مغز به شمار میآمدند .
3.4. تکنیکهای نوین مولکولی
برای شناسایی دقیق تغییرات ناشی از ژن APOE4 در سطح بیان ژنها و مسیرهای متابولیک، از تکنیکهای نوین مانند توالییابی RNA تک هستهای (snRNA-seq) استفاده شده است. به کمک این روش، پژوهشگران توانستند تغییرات بیان ژن در سلولهای مختلف مغزی، به ویژه در الیگودندروسیتها و آستروسیتها، و تأثیرات APOE4 را به صورت دقیق مشاهده کنند ، .
3.5. مدلهای نوترکیب لیپوپروتئینی
در برخی مطالعات، علاوه بر استفاده از سلولهای اصلی، پژوهشگران مدلهای نوترکیب لیپوپروتئینیای تولید کردند که تنها تفاوتشان در حضور APOE3 یا APOE4 بود. آزمونهای انجام شده روی این مدلها نشان داد که مدلهای حامل APOE4 کارایی انتقال کلسترول به نورونها را به طور قابل توجهی کاهش دادهاند.

4. نتایج حاصل از مطالعات مختلف
تحقیقات متعدد در سالهای اخیر به وضوح نقش مهم انتقال کلسترول در سلامت نورونی و بروز آلزایمر را نشان دادهاند. در این بخش مهمترین یافتههای پژوهشهای بررسی شده مورد توجه قرار میگیرند.
4.1. نقص در جذب کلسترول توسط نورونها
یکی از یافتههای کلیدی مطالعات نشان میدهد که در بیماران آلزایمر، هرچند ترشح کلسترول توسط آستروسیتها تغییر چندانی نمیکند، اما جذب این کلسترول توسط نورونها به طور قابل توجهی کاهش یافته است ، . این نقص در فرآیند جذب منجر به کاهش تأمین کلسترول لازم برای عملکرد صحیح نگهداری سیناپسها، تثبیت ساختار سلولی و میلیناسیون میشود ، .
4.2. تأثیر مستقیم APOE4 در انتقال ناکارآمد کلسترول
پژوهشهایی که با استفاده از مدلهای سلولی و نوترکیبهای لیپوپروتئینی انجام شدهاند، نشان دادهاند که وجود ژن APOE4، عملکرد انتقال گیرندههای لیپوپروتئینی به نورونها را مختل میکند ، . در شرایط آزمایشگاهی، مشاهده شده است که وقتی آستروسیتهای حامل APOE4 با نورونها همزمان میشوند، میزان کلسترول تحویل داده شده به نورونها به طرز قابل توجهی کاهش مییابد ، . این یافتهها به وضوح نشان میدهند که یکی از راهکارهای زیربنایی در بروز آلزایمر، اختلال در بهرهوری لیپوپروتئینهای حامل کلسترول است.
4.3. تجمع کلسترول در الیگودندروسیتها و اثرات آن بر میلیناسیون
تحقیقات انجام شده در مؤسسات معتبر همچون مونت سینا و MIT، نشان دادهاند که در حضور APOE4، کلسترول بهصورت غیرطبیعی در الیگودندروسیتها تجمع مییابد ، . این تجمع ماده چربی باعث اختلال در فرآیند میلینسازی میشود که نتیجه آن کاهش کیفیت پوشش میلینی سلولهای عصبی و کاهش کارایی انتقال سیگنالهای الکتریکی است ، . کاهش میلیناسیون میتواند موجب ایجاد مشکلات یادگیری و حافظه گردد که از علائم اولیه آلزایمر بهشمار میآید ، .
4.4. تغییرات پروتئومیک در لیپوپروتئینهای CSF
تجزیه و تحلیل پروتئومیک مایع مغزی نخاعی نشان داده است که در بیماران آلزایمر تعداد معینی از پروتئینهای وابسته به لیپوپروتئین تغییر یافتهاند . اگرچه تغییر در این پروتئینها مستقیماً به متابولیسم کلسترول مرتبط نبوده است، اما نشانگر این واقعیت است که سیستم انتقال چربی در مغز بسیار پیچیده بوده و سایر مکانیسمهایی مانند التهاب، چسبندگی سلولها و تخریب پروتئین نیز سهم بسزایی در پیشرفت بیماری دارند ، .
4.5. بررسیهای تکهستهای و تغییرات بیان ژن
استفاده از روشهای تکهستهای مانند snRNA-seq به محققان این امکان را داده تا تغییرات سطحی در بیان ژنهای مرتبط با متابولیسم کلسترول در سلولهای مختلف مغز، به ویژه در آستروسیتها و الیگودندروسیتها، را بهطور دقیق بررسی کنند ، . این روشها نشان دادهاند که در حضور APOE4، ژنهای مرتبط با سنتز کلسترول و انتقال آن به طور متفاوتی تنظیم میشوند که میتواند عاملی در اختلال کارکرد نورونی باشد.
4.6. تجزیه و تحلیل آماری و مقایسهای
برای نمایش بهتر نتایج بهدست آمده از مطالعات مختلف، جدول زیر به مقایسه عملکرد سیستم انتقال کلسترول بین نمونههای سالم و بیماران آلزایمر پرداخته است:
| پارامتر | نمونههای سالم | بیماران آلزایمر (خصوصاً در حضور APOE4) |
|---|---|---|
| ترشح کلسترول توسط آستروسیتها | مقدار تقریبی یکنواخت و بهینه | بدون تغییر قابل توجه در مقایسه با گروه کنترل |
| جذب کلسترول توسط نورونها | جذب کارآمد و کافی | کاهش قابل توجه در جذب کلسترول |
| عملکرد لیپوپروتئینی | انتقال بهینه کلسترول به نورونها | نقص عملکردی و انتقال ناکارآمد کلسترول |
| میلیناسیون | میلیناسیون سالم با پوشش کامل | کاهش میلین و پوشش ناقص نورونی |
نمودار جریان فرآیند انتقال کلسترول در مغز
برای تبیین بهتر فرآیند انتقال کلسترول از آستروسیتها به نورونها و تأثیر متغیرهای ژنتیکی، نمودار جریان زیر ارائه شده است:
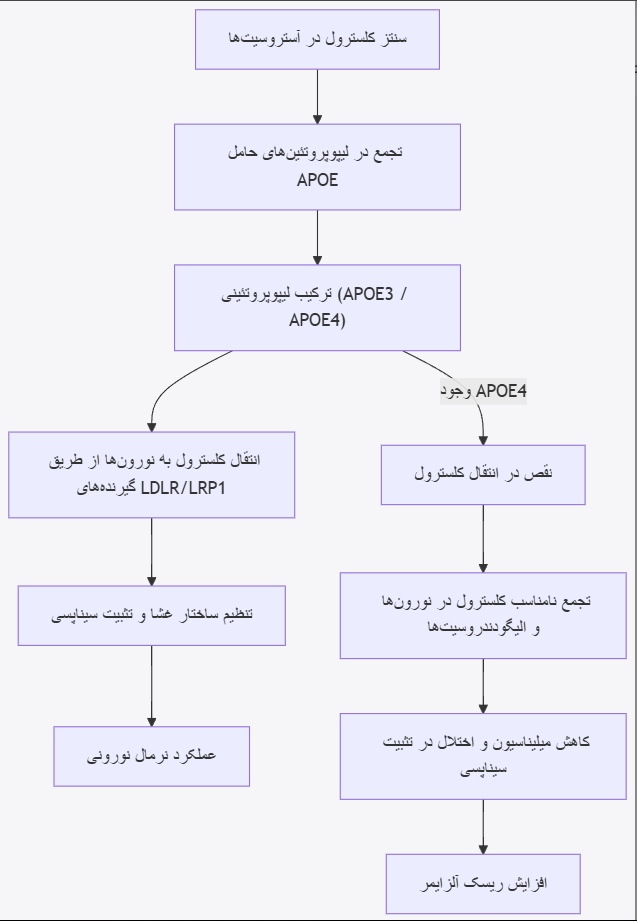
نمودار 1: نمودار جریان فرآیند انتقال کلسترول از آستروسیت به نورون با تأثیر ایزوفرمهای APOE3 و APOE4
5. بحث و نتیجهگیری
5.1. بحث
نتایج حاصل از مطالعات مختلف نشان میدهد که نقص در انتقال کلسترول از آستروسیتها به نورونها بهعنوان یکی از عوامل محرک بروز آسیبهای نورونی در بیماری آلزایمر عمل میکند. از آنجا که کلسترول برای تثبیت ساختار غشاها و عملکرد سیناپسی ضروری است، هرگونه کاهش در بهرهوری جذب کلسترول میتواند به کاهش عملکرد نورونی منجر شود ، . وجود ایزوفرم APOE4، که از نظر ژنتیکی به عنوان عامل خطر اصلی شناخته شده است، با نقص در فرآیند انتقال کلسترول به نورونها همراه بوده و میتواند از طریق دو مسیر عمده به بیماری آلزایمر دامن بزند:
-
نقص در انتقال به نورونها:
تحقیقات نشان دادهاند که لیپوپروتئینهای حاصل از آستروسیتهای حامل APOE4 نسبت به نمونههای حامل APOE3، توانایی کمتری در تحویل کلسترول به نورونها دارند ، . این نقص در فرآیند جذب کلسترول، منجر به کاهش فراوانی و پایداری سیناپسها شده که در نهایت میتواند علائم شناختی بیماران را تشدید کند. -
تجمع غیرطبیعی کلسترول در الیگودندروسیتها:
مطالعات اخیر بر روی نمونههای انسانی و مدلهای حیوانی نشان دادهاند که تجمع بیش از حد کلسترول در الیگودندروسیتها و کاهش میلیناسیون منجر به اختلال در انتقال سیگنالهای الکتریکی بین نورونها میشود ، . این اختلال در میلیناسیون، علاوه بر کاهش کارایی ارتباطات نورونی، میتواند به افزایش حساسیت نورونها به آسیبهای متابولیک و التهابی منجر شود.
از سوی دیگر، تغییرات پروتئومیک در لیپوپروتئینهای مایع مغزی نخاعی، پیچیدگی سیستم لیپوپروتئینی مغز را نشان میدهد. تغییرات در 27 پروتئین که در مطالعات مشاهده شدهاند، علیرغم اینکه به صورت مستقیم به متابولیسم کلسترول مرتبط نبودهاند، نمایانگر تداخل چندگانه در مسیرهای سلولی مانند التهاب و تخریب پروتئین میباشند که میتوانند به بروز آسیبهای نورونی کمک کنند ، .
5.2. نتیجهگیری
با توجه به شواهد ارائه شده، میتوان نتیجه گرفت که:
- کلسترول در مغز نقش بنیادی در ایجاد و حفظ ساختار سیناپسی، میلیناسیون و سلامت نورونی ایفا میکند ، .
- انتقال کلسترول از سلولهای گلیال به نورونها به واسطهٔ لیپوپروتئینهای حامل APOE از اهمیت ویژهای برخوردار بوده و هرگونه نقص در این فرآیند میتواند به آسیبهای نورونی منجر شود ، .
- ژن APOE4 با ایجاد نقص در لیپیداسیون و انتقال کلسترول، به عنوان بزرگترین عامل ژنتیکی خطر برای بیماری آلزایمر شناخته شده و میتواند در چندین مسیر مختلف از جمله کاهش جذب کلسترول توسط نورونها و تجمع نامناسب کلسترول در الیگودندروسیتها تأثیرگذار باشد ، .
- تغییرات پروتئومیک در سیستم لیپوپروتئینی مغز نشاندهندهٔ پیچیدگی فرآیندهای مولکولی و احتمالات متعدد در بروز و پیشرفت بیماری آلزایمر است که نیازمند بررسیهای بیشتر در مطالعات آینده میباشد .
جدول زیر نکات کلیدی یافتهها را به صورت مختصر ارائه میدهد:
| نکته کلیدی | توضیح مختصر |
|---|---|
| اهمیت کلسترول در مغز | نقش در تثبیت ساختار غشایی، انتقال سیناپسی و میلیناسیون نورونی |
| انتقال کلسترول از آستروسیت به نورونها | فرآیند وابسته به گیرندههای LDLR و LRP1، نقشی اساسی در سلامت نورونی |
| نقص در جذب کلسترول در بیماران آلزایمر | کاهش جذب باعث بروز نقصهای نورونی و ضعف سیناپتیک میشود |
| تأثیر ژن APOE4 | ایجاد نقص در لیپیداسیون و انتقال ناکارآمد کلسترول؛ افزایش خطر آلزایمر |
| تغییرات پروتئومیک سیستم لیپوپروتئینی مغز | تغییر در 27 پروتئین؛ نشاندهنده پیچیدگی در مسیرهای التهابی و تخریبی |
پیشنهادات و مسیرهای آینده پژوهش
با توجه به اهمیت بالای نقش کلسترول در عملکرد صحیح مغز و العلاقة مستقیم اختلالات در این مسیر با بیماری آلزایمر، تحقیقات آینده باید بر روی موارد زیر تمرکز کنند:
- بهبود در انتقال کلسترول: توسعه راهکارهای دارویی و مولکولی جهت بهبود کارایی لیپوپروتئینهای حامل کلسترول و افزایش جذب آن توسط نورونها.
- مدیریت ژنتیکی: شناسایی و هدف قرار دادن مسیرهای مولکولی آسیبرسان ناشی از ژن APOE4 برای کاهش خطر بروز آلزایمر.
- مطالعات جامع پروتئومیک: بررسی دقیقتر تغییرات پروتئومیک در سیستم لیپوپروتئینی مغز جهت شناسایی اهداف جدید در درمان بیماری.
- ارزیابی تاثیرات جانبی: بررسی اثر تغییرات متابولیکی کلسترول در سلولهای پشتیبان مغز مانند الیگودندروسیتها و ارتباط آن با مشکلات میلیناسیونی.
- مطالعات بالینی طولانیمدت: انجام مطالعات پایگاهدار بر روی گروههای مختلف با حضور یا عدم حضور ژن APOE4 برای ارزیابی دقیق عملکرد انتقال کلسترول و اثرات آن بر پیشرفت بیماری آلزایمر.
نتیجهگیری نهایی
این مقاله جامع با مروری بر مطالعات متعددی که در زمینه نقش انتقال کلسترول و تأثیر ژن APOE4 در بروز بیماری آلزایمر انجام شدهاند، نشان میدهد که:
- کلسترول به عنوان یک مولکول کلیدی در مغز، نقشهای مولکولی و ساختاری متعددی دارد که نقص در تأمین آن میتواند منجر به آسیب نورونی شود.
- انتقال کلسترول از آستروسیتها به نورونها از طریق لیپوپروتئینهای حامل APOE صورت میگیرد که در شرایط نرمال به بهینهترین نحو اجرایی میشود.
- وجود ژن APOE4 موجب اختلال در فرآیند لیپیداسیون و کاهش کارایی انتقال کلسترول میشود که به نوبه خود ریسک بروز و پیشرفت آلزایمر را افزایش میدهد.
- تغییرات مولکولی و پروتئومیک در سیستمهای لیپوپروتئینی مغز، بیانگر پویایی و پیچیدگی فرآیندهای سلولی است که در نتیجه آن، فرآیندهای التهابی و تخریبی نیز تشدید میشوند.
با توجه به یافتههای ارائهشده، میتوان نتیجه گرفت که رفع نقصهای سیستم انتقال کلسترول، به ویژه در حضور ژن APOE4، از جمله اهداف مهم برای توسعه راهکارهای درمانی جدید جهت کاهش شیوع و شدت علائم آلزایمر بهشمار میآید. پژوهشهای آینده در این زمینه میتوانند با استفاده از تکنیکهای نوین مولکولی و مدلهای بالینی، مسیرهای درمانی نوینی ارائه دهند که ضمن کاهش آسیبهای نورونی، به بهبود عملکرد شناختی بیماران نیز منجر شود.
تصاویر و نمودارهای تکمیلی
تصویر 1: نمای کلی مسیر انتقال کلسترول در مغز
این نمودار، فرآیند انتقال کلسترول از سلولهای آستروسیت به نورونها را نشان میدهد. در سمت چپ، سنتز کلسترول در آستروسیتها صورت میگیرد و پس از تجمع در قالب لیپوپروتئینهای حامل، از طریق گیرندههای سطح نورونی به نورونها انتقال مییابد. در بخش میانی، نقش ایزوفرمهای مختلف APOE در تعیین کارایی انتقال مشخص شده است و در سمت راست، نتیجه نهایی به دست آوردن کلسترول کافی برای تثبیت سیناپسی و حفظ عملکرد نرمال نورونی آورده شده است ، .
تصویر 2: تغییرات ساختاری در میلیناسیون
این تصویر، مقایسه بین ساختار میلینی نورونهای سالم و نورونهای بیماران آلزایمر را ارائه میدهد. در نورونهای سالم، پوشش میلینی کامل بوده و در نتیجه انتقال الکترواستانسی بهینه صورت میگیرد. در حالی که در نورونهای بیماران آلزایمر، بهویژه در حضور APOE4، کاهش میلیناسیون و پوشش ناقص مشاهده میشود که موجب کاهش سرعت انتقال سیگنالهای نورونی میگردد ، .
جدول 2: خلاصه نتایج مطالعات تجربی
| جنبه مورد بررسی | نمونههای سالم | بیماران آلزایمر (خصوصاً حامل APOE4) |
|---|---|---|
| ترشح کلسترول | مقدار یکنواخت و بهینه | مشابه؛ اما جذب به نورونها دچار نقص |
| جذب کلسترول توسط نورونها | جذب مؤثر و کافی | کاهش قابل توجه در جذب کلسترول |
| کارایی لیپوپروتئینهای حامل | انتقال بهینه کلسترول به نورونها | نقص کارکردی و انتقال ناکارآمد کلسترول |
| میلیناسیون نورونی | میلیناسیون کامل و پوشش سالم | کاهش میلین و پوشش نامناسب |
جدول 2: خلاصه مقایسهای نتایج بین نمونههای سالم و بیماران آلزایمر
نتیجهگیری کلی
در این مقاله بهطور جامع به بررسی فرآیندهای مولکولی و سلولی در انتقال کلسترول در مغز و تأثیر ژن APOE4 بر این فرآیند پرداختیم. یافتههای ارائهشده نشان میدهند که:
- اهمیت کلسترول: کلسترول نه تنها برای ساختار سلولی، بلکه برای پایداری سیناپسی و میلیناسیون نورونی حیاتی است.
- انتقال کلسترول: فرآیند انتقال کلسترول از آستروسیتها به نورونها از اهمیت ویژهای برخوردار بوده و نقص در این انتقال میتواند به اختلالات نورونی منجر شود.
- نقش APOE4: وجود ایزوفرم APOE4 موجب کاهش کارایی لیپوپروتئینهای حامل کلسترول شده و در نتیجه ایمنی نورونی را در برابر آسیبهای ناشی از کمبود تغذیه چربی تضعیف میکند.
- پیامدهای بالینی: اختلال در انتقال کلسترول و کاهش میلیناسیون، عوامل مهمی در بروز و پیشرفت بیماری آلزایمر محسوب میشوند.
- جهتهای پژوهشی: تمرکز بر بهبود فرآیند انتقال کلسترول و بررسی دقیق تأثیرات ژنتیکی میتواند مسیرهای درمانی جدیدی را برای مقابله با آلزایمر فراهم آورد.
با توجه به اهمیت فراوان این یافتهها، تلاشهای آتی باید بر بهینهسازی فرآیندهای سلولی مرتبط با متابولیسم کلسترول و هدف قرار دادن مسیرهای مولکولی آسیبرسان ناشی از ژن APOE4 متمرکز شوند. این رویکرد میتواند امیدبخش ظهور درمانهای جدید در مقابله با این بیماری مرگبار باشد.
جمعبندی نهایی
بهطور خلاصه، یافتههای بررسیهای انجامشده در زمینه انتقال کلسترول و تأثیر ژن APOE4 در بیماری آلزایمر نشان میدهد:
- اهمیت کلسترول در عملکرد نورونی: کلسترول برای نگهداری ساختار و عملکرد طبیعی نورونها ضروری است.
- اختلال در انتقال کلسترول: نقص در فرآیند انتقال کلسترول از آستروسیتها به نورونها، در بیماران آلزایمر مشاهده میشود و میتواند به کاهش عملکرد سیناپتیک و اختلال در ساختار میلین بیانجامد.
- تأثیر ژن APOE4: حضور APOE4 موجب کاهش کارایی لیپوپروتئینهای حامل کلسترول شده و باعث ایجاد نواقص کلیدی در عملکرد نورونی میشود.
- پیامدهای بالینی: کاهش جذب کلسترول و نقص میلیناسیون به عنوان عوامل موثر در بروز علائم شناختی و پیشرفت بیماری آلزایمر مطرح هستند.
- مسیرهای پژوهش آتی: پیگیری دقیق مسیرهای مولکولی و بهبود عملکرد انتقال کلسترول، میتواند در توسعه راهکارهای درمانی و پیشگیری از این بیماری نقش اساسی ایفا کند.
این مقاله بر اهمیت یکپارچهسازی دادههای مولکولی، سلولی و بالینی تأکید کرده و ترسیم راههای جدید برای درمان آلزایمر را پیشنهاد میدهد. با ادامه تحقیقات در این زمینه، امید میرود که بتوان از طریق بهبود انتقال کلسترول و تنظیم عملکرد سلولهای گلیال، زمینههای بهبودی تأثیرگذار در پیشگیری و درمان بیماری آلزایمر فراهم گردد.